Animais e a pandemia de COVID-19. Qual o envolvimento deles?
A pandemia de COVID-19 ficará marcada como um dos eventos mais desafiadores e complexos da história da humanidade. Os primeiros casos da COVID-19 foram notificados em Wuhan, na China. Em poucos meses, todos os países do mundo registraram números elevados de casos e com crescimento galopante. Milhões de pessoas passaram a adoecer por causa de uma doença infecciosa respiratória grave e que leva a complicações sistêmicas. Seu causador é o coronavírus conhecido como SARS-CoV-2 (sigla do inglês que significa coronavírus 2 da síndrome respiratória aguda grave). Esse coronavírus passou a ser amplamente estudado para que terapias e vacinas fossem desenvolvidas, e também para entender melhor a ação viral durante a doença.
O senso de urgência acelerou o detalhamento do código genético do SARS-CoV-2. Com o sequenciamento do genoma do SARS-CoV-2 foi possível compará-lo com genomas de outros vírus. Então, descobriu-se que o SARS-CoV-2 seria muito similar a outros coronavírus já identificados em morcegos (morcegos-ferradura), há anos atrás. A partir daquele momento, os morcegos passaram a ser considerados hospedeiros naturais do recém-identificado coronavírus.
A comunidade científica não se surpreendeu pelo fato de os morcegos serem hospedeiros de um novo coronavírus. Há mais de uma década a comunidade científica vem alertando para o risco de um evento de transmissão em larga escala por um novo coronavírus (1). Em diferentes regiões do planeta, morcegos portadores de coronavírus já tinham sido encontrados. No Brasil, onde há grande diversidade de espécies, alguns morcegos foram identificados portando coronavírus comparáveis ao SARS-CoV-1, que foi o responsável pelo surto de SARS, em 2003-2004, na China (2).
Os morcegos são considerados grandes reservatórios de vírus e por isso possuem uma alta capacidade de transmiti-los para outras espécies. Ao usar seu sonar, por exemplo, morcegos liberam aerossóis e partículas de saliva que podem estar carregadas de potenciais patógenos (3), como o SARS-CoV-2. Durante suas refeições, fragmentos de alimentos contendo saliva contaminada podem cair e entrar na rota de outros animais. Além disso, existem morcegos que se alimentam diretamente do sangue de mamíferos, inoculando vírus no ato de sua alimentação. Por fim, o comportamento migratório de muitos morcegos, a grandes distâncias, aumenta seu potencial de transmissão (4). Somando todos esses fatos, é grande a possibilidade de um vírus saltar do morcego a outros mamíferos, encontrando aí novos hospedeiros. A devastação do meio ambiente expõe os humanos nessa rota de transmissão. Hábitos humanos, como a exploração animal, permitem que espécies de convívio casual, passem a compartilhar o mesmo ambiente, quando capturados, seja em transportes lotados de animais ou em recintos com área reduzida. É com essa perspectiva que suspeita-se que os morcegos teriam transmitido seus coronavírus para outras espécies de mamíferos, como o pangolim, por exemplo.
Outros coronavírus com grande similaridade ao SARS-CoV-2 foram detectados em pangolins um ano antes do início da pandemia (5). Pangolins sempre foram negociados em muitos mercados de animais, na China. No mercado de Huanan, em Wuhan, um dos locais em que se suspeita que a pandemia tenha iniciado, eram negociados tanto pangolins quanto morcegos. Por conta desse cenário, levantou-se forte suspeita de que o pangolim seria um hospedeiro intermediário durante o processo de origem do SARS-CoV-2.
No entanto, o caminho que o SARS-CoV-2 teria feito até chegar aos humanos e desencadear a pandemia ainda não foi bem desvendado. Mesmo não havendo comprovação de quais animais teriam sido hospedeiros intermediários, sabe-se que o SARS-CoV-2 abriga-se em uma diversidade bastante significativa de animais. Ao longo da pandemia, foram observados animais susceptíveis ao vírus. O SARS-CoV-2 foi detectado em animais de companhia, como cães, gatos, furões e hamsters. Cães pareciam ser menos suscetíveis ao SARS-CoV-2, apresentando sinais clínicos menores. Gatos, furões e hamsters foram os mais afetados, apesar do baixo número de casos e também uma menor letalidade (6,7).
A detecção de SARS-CoV-2 em hamsters causou uma certa apreensão. Hamsters infectados apresentam curso clínico muito similar ao que ocorre em humanos (6). Além disso, os hamsters têm potencial de se infectar e transmitir de volta o SARS-CoV-2 aos humanos (8). A preocupação de cientistas e autoridades ocorreu pelo fato do vírus poder se adaptar e se modificar de modo significativo a ponto de aumentar seus efeitos após a infecção de volta aos humanos. Porém, a cadeia de transmissão envolvendo hamsters e humanos parece não ter causado um impacto evidente ao longo da pandemia.
Em fazendas, rebanhos de bovinos, caprinos e suínos, não sofreram diante da pandemia. Mas isso não ocorreu por falta de exposição, visto que, trabalhadores de fazenda apresentaram um dos maiores índices de infecção pelo SARS-CoV-2 dentre todas as profissões (9). Estudos mostraram que bois, cabras ou porcos, só eram infectados por meio experimental, em laboratório, e mesmo assim, não eram hospedeiros “bons” o suficiente para que o coronavírus pudesse se replicar e infectar vários deles, como acontece com os humanos (10). Assim, os animais de fazenda não fizeram parte de uma cadeia de transmissão do SARS-CoV-2 junto com os humanos. Isso, até que o visom, um animal mais parecido com a lontra, e também da família dos furões, foi contaminado naturalmente.
Os visons formam rebanhos em fazendas de países europeus e têm sua pele extraída para confecção de casacos, por exemplo. Logo, esses animais foram infectados pelo SARS-CoV-2 por meio de seus tratadores e passaram a se infectar uns aos outros. O SARS-CoV-2, ao circular entre os visons, retornou a seus hospedeiros principais, os humanos (11). Além disso, gatos domésticos que circulavam nas redondezas das fazendas foram infectados por meio dos visons, aumentando a complexidade da cadeia (12). O receio de que os visons pudessem servir de abrigo ao SARS-CoV-2 e permitir que o vírus evoluísse até que linhagens mais perigosas surgissem, levou as autoridades a decretar o sacrifício de milhares de visons em localidades contaminadas.
Com um número cada vez maior de pessoas expostas aos SARS-CoV-2, o vírus se tornou mais eficiente em se disseminar, na medida em que novas variantes surgiram. Permanecer isolado, evitando contato com outras pessoas, ou deixando de fazer parte de aglomerações, tornou-se uma das poucas estratégias a ser adotada, enquanto se esperava o desenvolvimento de vacinas. No entanto, essa opção não era universal. Devido a atividades econômicas específicas, ou mesmo por opção, enorme parcela da população persistia em contato entre si. Indivíduos infectados levaram o SARS-CoV-2 para dentro de zoológicos. Grandes felinos mostraram-se suscetíveis ao coronavírus (13). O SARS-CoV-2 foi detectado em tigres e leões de diferentes zoológicos. Grande parte desses animais apresentaram sintomas. Entre leões, o SARS-CoV-2 passou a ser disseminado. Mais tarde, o SARS-CoV-2 também foi detectado em leões vivendo em seu habitat (14).
Um interessante estudo mostrou que os animais mais suscetíveis ao SARS-CoV-2 possuem maior quantidade de receptores utilizados pelo vírus para invadir células hospedeiras, comparando com animais de baixa susceptibilidade (15). Humanos, felinos e mustelídeos (como o furão e o visom) possuem mais receptores em seus órgãos e tecidos do que os cães ou bovinos, por exemplo. E essa diferença ocorre em órgãos centrais, como os pulmões. Tal particularidade ajuda a explicar o porquê a COVID-19 leva a acometimento pulmonar e extrapulmonar.
Estudos de vigilância epidemiológica passaram a investigar diferentes animais para tentar identificar espécies que poderiam contribuir para a cadeia de transmissão do SARS-CoV-2. Conhecer os animais que poderiam abrigar o SARS-CoV-2 é relevante, pois permite elaborar estratégias de controle. Várias espécies foram descartadas como potenciais hospedeiros do SARS-CoV-2. No entanto, uma espécie suscetível ao SARS-CoV-2 passou a chamar a atenção de epidemiologistas, o veado-de-cauda-branca. Este animal é um cervo que compõem uma grande população na América do Norte. O veado-de-cauda-branca possui uma população de mais de 30 milhões de indivíduos. O contato humano com esse animal é frequente, por ser caçado ou mantido em fazendas. Além disso, o veado-de-cauda-branca coexiste em vários cenários com os humanos, causando danos em plantações, e sendo alvo frequente de acidentes de trânsito.
Meses após o anúncio de que o veado-de-cauda-branca seria suscetível ao SARS-CoV-2 (16), diferentes estudos identificaram o vírus circulando entre esses animais na natureza e em fazendas (17,18). Alarmantemente, no Canadá, um paciente com COVID-19 teve o SARS-CoV-2 sequenciado, mostrando que sua cepa era bastante próxima às cepas encontradas em veados-de-cauda-branca (19). Tal fato sugere que o SARS-CoV-2 teria pulado do humano para os veados e teve seu retorno aos humanos, devido à capacidade adaptativa do SARS-CoV-2 (embora não tenha sido confirmado). Vale lembrar que os veados estão distribuídos ao redor de todo o mundo compondo grandes populações que, geneticamente, pouco diferem do veado-de-cauda-branca.
A América do Sul, em especial o Brasil, engloba uma grande diversidade de veados, incluindo aqueles cujo perfil genético mais se aproxima do o veado-de-cauda-branca. No entanto, embora alguns alertas e cartas científicas tenham sido publicados, nenhum estudo de vigilância epidemiológica foi direcionado a esses animais. Considerando que o governo brasileiro pouco se ateve aos testes na população humana, não é de se estranhar que a vigilância virológica em animais teria alguma atenção.
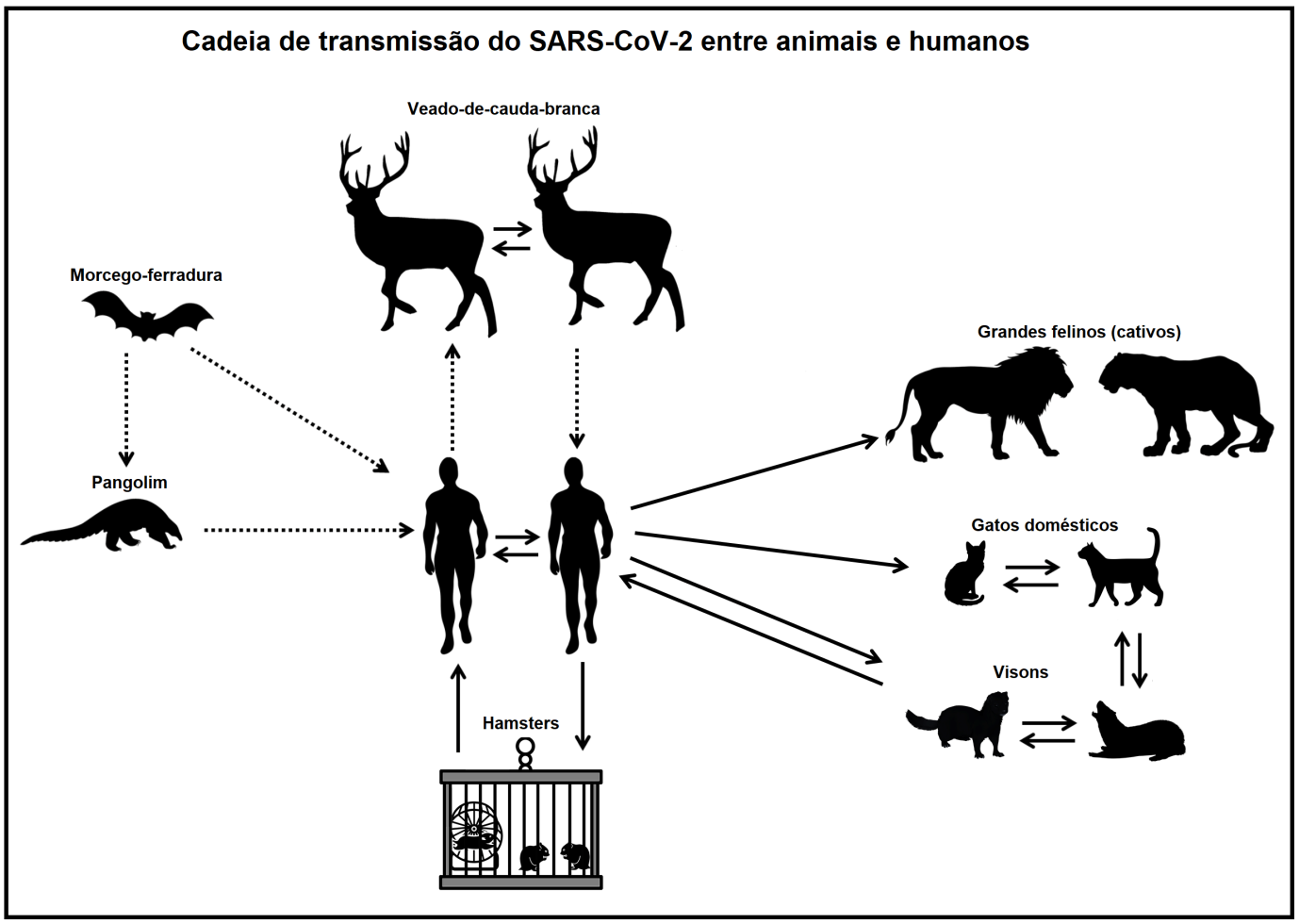
Representação resumida do cenário envolvendo animais suscetíveis ao SARS-CoV-2. As linhas pontilhadas representam transmissão não confirmada entre espécies, enquanto a linha reta representa infecção confirmada
Grande parte da população brasileira vive próxima a ambientes selvagens, muitas vezes explorando esses ambientes para subsistência. A coexistência da população, cujos os índices de COVID-19 foram muito elevados, com animais silvestres, pode ter favorecido a transmissão do SARS-CoV-2. No Brasil, algumas espécies foram confirmadas como suscetíveis à infecção pelo SARS-CoV-2, como a onça-parda, o quati, o sagui e o veado-de-cauda-branca. No entanto, houve pouco empenho do governo para aumentar a vigilância epidemiológica a fim de investigar a presença de SARS-CoV-2 em diferentes animais endêmicos do território brasileiro.
Poucos países realizaram estudos epidemiológicos amplos e contínuos durante a pandemia de COVID-19. É preciso que os governos locais invistam na investigação que revele potenciais hospedeiros e que a vigilância seja contínua. Um patógeno que compartilhamos hoje com animais, pode se adaptar em novos hospedeiros, evoluir e se tornar uma nova ameaça de grande potencial. Por isso, a vigilância epidemiológica atuante pode evitar a disseminação de novas ameaças infecciosas, salvaguardando não somente nossa espécie, mas também espécies que coexistem conosco. Embora o impacto da circulação do SARS-CoV-2 em mamíferos não seja evidente, as consequências do coronavírus saltando entre diferentes hospedeiros não dever ser subjugada. A história está nos ensinando que os surtos e epidemias de coronavirus têm se tornado cada vez mais frequentes. Considerando que uma mudança cultural, sem exploração animal, parece cada vez mais difícil de acontecer, é imprescindível que haja vigilância epidemiológica efetiva a fim de antecipar o estabelecimento de novos surtos de coronavírus.
Autor: Luciano R. Lopes
Revisor: Antonio Carlos da Silva Junior
Revisor: Vitor Tonini Machado
Referências
1. Lopes LR. Coronavírus: a Ameaça (Des)conhecida. Departamento de Informática em Saúde - Escola Paulista de Medicina - EPM. 2021 [cited 2022 Aug 29]. Disponível em: https://sp.unifesp.br/epm/dis/noticias/coronavirus-a-ameaca-des-conhecida
2. Corman VM, Rasche A, Diallo TD, Cottontail VM, Stöcker A, Souza BF de CD, et al. Highly diversified coronaviruses in neotropical bats. J Gen Virol. 2013 Sep;94(Pt 9):1984–94.
3. Calisher CH, Childs JE, Field HE, Holmes KV, Schountz T. Bats: important reservoir hosts of emerging viruses. Clin Microbiol Rev. 2006 Jul;19(3):531–45.
4. Popa-Lisseanu AG, Voigt CC. Bats on the Move. J Mammal. 2009 Dec 15;90(6):1283–9.
5. Lopes LR, de Mattos Cardillo G, Paiva PB. Molecular evolution and phylogenetic analysis of SARS-CoV-2 and hosts ACE2 protein suggest Malayan pangolin as intermediary host. Braz J Microbiol. 2020 Jun 26 [cited 2020 Aug 17]; Disponível em: https://doi.org/10.1007/s42770-020-00321-1
6. Shou S, Liu M, Yang Y, Kang N, Song Y, Tan D, et al. Animal Models for COVID-19: Hamsters, Mouse, Ferret, Mink, Tree Shrew, and Non-human Primates. Front Microbiol. 2021 [cited 2022 Aug 29];12. Disponível em: https://www.frontiersin.org/articles/10.3389/fmicb.2021.626553
7. Giraldo-Ramirez S, Rendon-Marin S, Jaimes JA, Martinez-Gutierrez M, Ruiz-Saenz J. SARS-CoV-2 Clinical Outcome in Domestic and Wild Cats: A Systematic Review. Animals. 2021 Jul;11(7):2056.
8. Yen HL, Sit THC, Brackman CJ, Chuk SSY, Gu H, Tam KWS, et al. Transmission of SARS-CoV-2 delta variant (AY.127) from pet hamsters to humans, leading to onward human-to-human transmission: a case study. The Lancet. 2022 Mar 12;399(10329):1070–8.
9. Lewnard JA, Mora AM, Nkwocha O, Kogut K, Rauch SA, Morga N, et al. Prevalence and Clinical Profile of Severe Acute Respiratory Syndrome Coronavirus 2 Infection among Farmworkers, California, USA, June–November 2020. Emerg Infect Dis. 2021 May [cited 2021 Oct 12];27(5). Disponível em: https://wwwnc.cdc.gov/eid/article/27/5/20-4949_article
10. Ulrich L, Wernike K, Hoffmann D, Mettenleiter TC, Beer M. Experimental Infection of Cattle with SARS-CoV-2. Emerg Infect Dis. 2020 Dec [cited 2021 Oct 12];26(12). Disponível em: https://wwwnc.cdc.gov/eid/article/26/12/20-3799_article
11. Munnink BBO, Sikkema RS, Nieuwenhuijse DF, Molenaar RJ, Munger E, Molenkamp R, et al. Transmission of SARS-CoV-2 on mink farms between humans and mink and back to humans. Science. 2021 Jan 8;371(6525):172–7.
12. van Aart AE, Velkers FC, Fischer EAJ, Broens EM, Egberink H, Zhao S, et al. SARS-CoV-2 infection in cats and dogs in infected mink farms. Transbound Emerg Dis. 2021 Jun 3;
13. McAloose D, Laverack M, Wang L, Killian ML, Caserta LC, Yuan F, et al. From People to Panthera: Natural SARS-CoV-2 Infection in Tigers and Lions at the Bronx Zoo. mBio. 2020 Oct 13;11(5).
14. Koeppel KN, Mendes A, Strydom A, Rotherham L, Mulumba M, Venter M. SARS-CoV-2 Reverse Zoonoses to Pumas and Lions, South Africa. Viruses. 2022 Jan;14(1):120.
15. Chen D, Sun J, Zhu J, Ding X, Lan T, Zhu L, et al. Single-cell screening of SARS-CoV-2 target cells in pets, livestock, poultry and wildlife. 2020 Jun [cited 2021 Oct 24] p. 2020.06.13.149690. Disponível em: https://www.biorxiv.org/content/10.1101/2020.06.13.149690v1
16. Palmer MV, Martins M, Falkenberg S, Buckley A, Caserta LC, Mitchell PK, et al. Susceptibility of white-tailed deer (Odocoileus virginianus) to SARS-CoV-2. J Virol. 2021 Mar 10 [cited 2021 Apr 6]; Disponível em: https://jvi.asm.org/content/early/2021/03/09/JVI.00083-21
17. Roundy CM, Nunez CM, Thomas LF, Auckland LD, Tang W, Richison JJ, et al. High Seroprevalence of SARS-CoV-2 in White-Tailed Deer (Odocoileus virginianus) at One of Three Captive Cervid Facilities in Texas. Microbiol Spectr. 2022;10(2):e00576-22.
18. Hale VL, Dennis PM, McBride DS, Nolting JM, Madden C, Huey D, et al. SARS-CoV-2 infection in free-ranging white-tailed deer. Nature. 2022 Feb;602(7897):481–6.
19. Pickering B, Lung O, Maguire F, Kruczkiewicz P, Kotwa JD, Buchanan T, et al. Highly divergent white-tailed deer SARS-CoV-2 with potential deer-to-human transmission. bioRxiv; 2022 [cited 2022 Apr 28]. p. 2022.02.22.481551. Disponível em: https://www.biorxiv.org/content/10.1101/2022.02.22.481551v1


Redes Sociais